علمی
عمومی
نور یک موج است که برای وجود داشتن نیاز به محیط ندارد. این موج، الکترومغناطیسی است؛ یعنی از یک میدان الکتریکی و یک میدان مغناطیسی تشکیل شده که هنگام حرکت در خلأ، یکدیگر را با یک زاویه قائم قطع میکنند. فاصله بین قلههای متوالی میدان الکتریکی یا مغناطیسی، طول موج است
برای پاسخ به این سؤال باید برخی خصوصیات مهم نور را بشناسیم. هر موجی در اصل فقط راهی برای انتقال انرژی از یک مکان به مکان دیگر است. برای انتقال انرژی، هر کدام از ذرات این موج کل مسیر را طی نمیکنند و انرژی توسط حرکات نسبتاً کوچک محلی هر ذره در محیط منتقل میشود. اگر پرتویی از نور را به شکل موج آب در نظر بگیریم، میتوان درک کرد که وقتی میگوییم فاصله بین دو قله، طول موج است به چه معناست. این فاصله میتواند بین هر دو موقعیت یکسان در موج در نظر گرفته شود. این قلههای موج را در حال عبور از چپ به راست تصور کنید. اگر تعداد قله عبوری از یک نقطه خاص را در یک ثانیه حساب کنید، عدد به دست آمده فرکانس نور است. سرعت نور همه جا و برای همه طول موجها ثابت است.
با افزایش طول موج، فرکانس کاهش مییابد. هر فرکانس خاص نور دارای انرژی منحصر به فردی است. هرچه فرکانس بیشتر باشد، انرژی نور نیز بیشتر میشود.
در هر طیف، نقطه یا نقاطی وجود دارد که که نسبت به نقاط همجوار خود در ارتفاع بالاتری قرار دارد (روی محور y). به هر کدام از این نقاط یک قله یا پیک گفته میشود.
طیف سنجی مرئی/فرابنفش/فروسرخ نزدیک
این نوع طیف سنجی از ناحیه فرابنفش (۱۷۰ تا ۳۸۰ نانومتر) تا مرئی (۳۸۰ تا ۷۸۰ نانومتر) و فروسرخ نزدیک (۷۸۰ تا ۳۳۰۰ نانومتر) را پوشش میدهد. در واقع مرز دقیقی بین این نواحی وجود ندارد و کافیست از الگوی کلی آگاه باشید. بیشتر اسپکترومترها و اسپکتروفتومترها در ناحیه ۱۹۰ تا ۱۱۰۰ ساخته میشوند
این موضوع رابطه نزدیکی با مکانیک کوانتوم دارد. با حل معادلات مکانیک کوانتوم که مربوط به الکترونهای یک اتم است، مدلی ارائه میشود:
الکترونها دارای انرژی گسسته هستند. E0 حالت پایه و به ترتیب E1، E2 و … حالتهای برانگیخته نامیده می شوند. برای اینکه انرژی الکترون از E0 به E1 تغییر کند، نوری با انرژی E0-E1 باید به الکترون برخورد کند. این معنای جذب نور است. الکترونها دارای سطوح انرژی خاصی هستند و نور، انرژی لازم برای تغییر انرژی الکترونها را دارد.
از آنجا که حالت انرژی بالاتر ناپایدار است، الکترون به زودی به حالت پایه برمی گردد. انرژی آزاد شده هنگام بازگشت الکترون، به گرما تبدیل میشود. اگر به دلایلی به گرما تبدیل نشود، انرژی به صورت نور تخلیه میشود. طیف سنجی اندازه گیری کمّی این فرایند است.
خروجی اسپکتروفتومتر معمولاً یک طیف (گراف) است که مقادیر نور انتقالی، جذب شده یا بازتابی (محور y) را بر حسب مقادیر مختلف طول موج نور (محور x) نشان میدهد.
چهار مد معمول جمعآوری داده برای اسپکتروفتومتر معمولی وجود دارد.
- مد اسکن: متداولترین حالت، اسکن طول موج است. دستگاه از بلندترین طول موج به کوتاهترین آنها اسکن می کند. از روش اسکنی زمانی استفاده میشود که ماده به نور فرابنفش حساس باشد و تابش طولانی مدت نور موجب تجزیه آن شود.
- مد Quant: مقدارسازی معمولاً در قله اصلی نمونه انجام میشود. دادهها را میتوان به صورت ارتفاع قله جمعآوری کرد. قانون Beer بیان میکند که جذب نمونه با غلظت متناسب است. ابتدا طیف گیری از مرجع انجام میشود و سپس طیف نمونهها با استفاده از تحلیل آماری حداقل مربعات بررسی میشوند. غلظت نمونههای ناشناخته را میتوان از معادله خط محاسبه کرد.
- مد فوتومتریک: گاهی اوقات نیازی به اسکن طول موج نیست اما لازم است دادههای چندگانه طول موجهای ناپیوسته را جمعآوری کرد. حالت فوتومتریک امکان جمعآوری این دادهها را فراهم میکند. این فرایند معمولاً برای صرفه جویی در وقت انجام میشود؛ زیرا این عملکرد سریعتر از اسکن طول موج است.
مد Time Drive: این مد دادهها را از یک طول موج ثابت به عنوان تابعی از زمان جمع میکند. اغلب برای تجزیه و تحلیل جنبشی برای بررسی تغییرات نمونهها در طول زمان استفاده میشود
برای هر طول موج از نور که از اسپکترومتر عبور میکند، شدت نور عبوری از نمونه اندازهگیری میشود. شدت نور وارد شده به نمونه را معمولاً با I۰نشان میدهند. شدت نور عبوری از نمونه که به آشکارساز برخورد میکند با I۱ نشان داده میشود. حال اگر درصد نسبت این دو (I۱/I۰)*۱۰۰ را حساب کنیم مقدار عبور (%T) به دست میآید که برابر مقدار نوری است که از نمونه عبور کرده و به آشکارساز میرسد. اگر I۱ کمتر از I۰ باشد، مشخص میشود که نمونه مقداری از نور را جذب کرده است. کامپیوتر با پردازش ریاضیاتی، این عدد را به عدد جذب A تبدیل میکند. جذب در واقع اندازهگیری مقدار نوری است که توسط نمونه ناپدید میشود. قانون بیرلامبرت رابطه بین غلظت نمونه c، طول مسیر نمونه L نور برخوردی و عبوری است:
اسپکتروفتومترها عموماً بازه جذب ۰ تا ۳ دارند اما اسپکتروفتومترهای گران قیمت میتوانند بازه بزرگتری نیز داشته باشند. جذب ۰ به این معنی است که نمونه هیچ نوری جذب نکرده و شدت نور برخوردی به نمونه با شدت نور خروجی یکی است. بنابراین نسبت I۱/I۰ برابر یک و منفی لگاریتم آن برابر صفر است. جذب ۱ زمانی اتفاق میافتد که ۹۰ درصد نور در آن طول موج جذب شده باشد. اکنون نسبت I۱/I۰ ده به صد است و منفی لگاریتم آن برابر یک است.
جذب، یک مقیاس لگاریتمی شبیه به مقیاس Richter است که برای زمین لرزه استفاده میشود. افزایش یک واحد در مقیاس جذب به معنی ده واحد کاهش در مقیاس عبور است.
ξ نماد جذب مولار است و با عنوان ضریب خاموشی نمونه نیز شناخته میشود. ξ ثابت فیزیکی واحدی در شیمی است که مربوط به توانایی نمونه در جذب نور در یک طول موج خاص میشود. همانند طول مسیر b و غلظت c، ξ نیز با جذب رابطه مستقیم دارد. رابطه به صورت زیر است:
A = ξbc
مد Quant: مقدارسازی معمولاً روی بزرگترین قله نمونه انجام میشود. اطلاعات میتواند به صورت ارتفاع قله یا مساحت زیر نمودار ذخیره شود. قانون بیر بیان می کند که جذب نمونه با غلظت رابطه مستقیم دارد. ابتدا طیف نمونههای استاندارد اندازهگیری میشود. پس از محاسبه غلظت استانداردها، غلظت نمونهها از رابطه خط برازش شده به دست میآید. اگر تنها یک نمونه استاندارد استفاده میشود، رابطه، خطی در نظر گرفته میشود.
به بیان دیگر، ξ، اندازه گیری مقدار نور جذب شده به ازای هر واحد غلظت در یک طول موج خاص است. جذب مولار برای هر ماده عدد ثابتی است؛ بنابراین اگر غلظت محلول نصف شود، جذب نیز نصف می شود. اگر مقدار جذب مولار، طول مسیر نور و غلظت را داشته باشیم، مقدار جذب در یک طول موج خاص قابل محاسبه است.
A = -log۱۰ (I۱/I۰) = a*b*c
A = a*b*c
علی رغم اینکه این قانون بسیار ساده به نظر میرسد، گاهی افراد هنگام کار کردن با آن دچار مشکل میشوند. ما تا به حال تنها مقدار نور ورودی به نمونه و نور خروجی از آن را در نظر میگرفتیم. سه عامل مهم دیگر که به نمونه وابسته هستند وجود دارند که جذب را توصیف میکنند.
این عوامل عبارتند از:
- طول نمونه (با b نشان داده میشود).
- غلظت نمونه (با c نشان داده میشود).
- ضریب خاموشی نمونه (با a نشان داده میشود) و گاهی با عنوان جذب مولار نیز خوانده میشود.
ضریب خاموشی یک ویژگی مربوط به مولکول و ساختار شیمیایی نمونه است. این مقدار برای یک ساختار شیمیایی ثابت، تغییر نمیکند
درک تفاوت مقدار و غلظت یک نمونه در علم شیمی بسیار مهم است. مقدار در واقع کمیت یک ماده است. در حالی که غلظت، مقدار یک ماده در حجمی از یک ماده دیگر است. بنابراین ۱۰ گرم شکر، یک مقدار است و ۱۰ گرم شکر محلول در ۱۰۰ میلی لیتر آب، بیانگر غلظت است. در شیمی معمولاً مقدار را با مول و غلظت را با مولار بیان میکنند. یک مول از یک ماده، وزن مولکولیِ ترکیب است که با گرم بیان میشود. بنابراین اگر وزن مولکولی یک ترکیب ۲۴۵ باشد، یک مول از آن ترکیب ۲۴۵ گرم خواهد بود. یک محلول یک مولی از آن نیز ۲۴۵ گرم از ماده است که در یک لیتر محلول حل شده است.
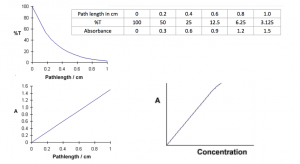
فرض کنید یک محلول مس سولفات داریم (این محلول آبی رنگ است چرا که قله جذبی در ۶۰۰ نانومتر دارد). زمانی که نور از داخل محلول داخل کووت یک سانتیمتری عبور میکند، تغییر شدت خواهد داشت. قانون بیر بیان میدارد که بخشی از نور که توسط هر میلیمتر از ماده جذب میشود، یکسان است. این ارتباط در نمودار جذب به صورت خطی نشان داده میشود اما در نمودار عبور، یک منحنی خواهیم داشت و این موضوع تفاوت مهمی است که پژوهشگران را به استفاده از نمودار جذب ترغیب میکند؛ چرا که در ریاضیات کار کردن با خط از کار کردن با منحنی سادهتر است.
معادله A=abc بیان می دارد که اگر نمودار جذب را بر حسب طول موج رسم کنیم، خطی به دست می آوریم که از مختصات (۰و۰) عبور میکند. رابطه خطی بین غلظت و جذب هر دو مستقیم است و به همین دلیل ترجیح میدهیم برای بیان قانون بیر لامبرت به جای عبور از جذب استفاده کنیم. در طیف سنجی با استفاده از جذب میتوانیم غلظت هر ماده را محاسبه کنیم
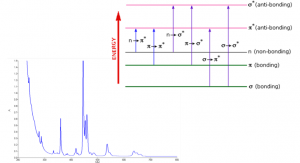
انتقالات الکترونی در ناحیه مرئی فرابنفش را در نظر بگیرید. این نور در مقایسه با نور فروسرخ نزدیک، انرژی بیشتری (کافی) برای انتقالات الکترونی دارد. این نوع انتقالات در اتم یا مولکول، الکترونها را از سطوح انرژی پایینتر به سطوح انرژی بالاتر منتقل میکند.
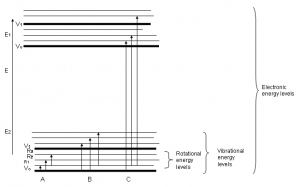
ابتدا توضیح میدهیم که زمانی که ترکیبات آلی، نور مرئی، فرابنفش یا فروسرخ نزدیک را جذب میکنند، چه اتفاقی میافتد و چرا طول موج نور جذب شده از یک ترکیب تا ترکیب دیگر تفاوت میکند. به زبان ساده، انرژی حاصل از نور به الکترونهایی منتقل میشود که در پیوند شیمیایی نقش دارند. این موجب میشود که الکترونها با جذب نور به سطح انرژی بالاتر منتقل شوند. این سطوح انرژی با اوربیتالهای پیوندی و ضد پیوندیِ اتمهای کربن دوگانه یا سه گانه و یا سیستمهای حلقهای از نوع بنزن معطر در مولکولهای آلی مرتبط است. به یاد داشته باشید که نمودار فوق به منظور مقیاسگذاری نیست و فقط قرارگیری نسبی اوربیتالهای مختلف را نشان میدهد. زمانی که نور از درون ترکیب عبور میکند، انرژی نور برای انتقال الکترون از یک اوربیتال پیوندی یا غیر پیوندیِ سطح انرژی پایین به اوربیتالهای ضد پیوندی خالی با سطوح انرژی بالاتر منتقل میشود. جهشهای الکترونی که نور باعث ایجاد آن میشود در شکل بالا نشان داده شده است.
طول فلش، متناسب با مقدار انرژی مورد نیاز برای انتقال الکترون به تراز انرژی بالاتر است. بنابراین اگر جهش انرژی بزرگتری داشته باشیم، نور با فرکانس بالاتر یا طول موج کمتر جذب خواهد شد.
تشبیه دنیای واقعی: انتقال الکترون به سطح انرژی بالاتر شبیه پرتاب یک توپ به هوا است. انرژی ماهیچهها (نور) به توپ (الکترون) منتقل و موجب شده که خلاف انرژی گرانشی زمین (حالت پایه) حرکت کند. سپس توپ به یک ارتفاع مشخص (حالت برانگیخته) میرسد. این ارتفاع توسط مقدار انرژی ماهیچه که به توپ داده شده (طول موج نور) تعیین میشود. این روند جذب نور (به طور خلاصه) است. همانطور که توپ دوباره به زمین برمیگردد، با خاموش شدن انرژی نور، همین اتفاق برای الکترون ارتقا یافته میافتد و دوباره به حالت پایه برمیگردد. انرژی الکترون در هنگام سقوط به صورت گرما یا نور (فلورسنس و یا فسفرسنس) آزاد میشود. این نور ساطع شده را میتوان با طیف سنجی لومینسانس بررسی نمود.
مهمترین جهشهای اوربیتالی الکترونی برای طیف سنجی UV/Vis عبارتند از:
- از اوربیتالهای پیوندی pi به اوربیتالهای ضد پیوندی pi (π به π*)
- از اوربیتالهای غیر پیوندی به اوربیتالهای ضد پیوندی pi (n به π*)
- از اوربیتالهای غیر پیوندی به اوربیتالهای ضد پیوندی سیگما (n به σ*)
این یعنی به منظور جذب نور در ناحیه ۲۰۰ تا ۸۰۰ نانومتر (ناحیه طیفگیری) مولکول میبایست دارای سیستمهای حلقهای آروماتیک، پیونده دوگانه، پیوندهای pi و یا اتمهایی با اوربیتالهای غیر پیوندی باشد. به یاد داشته باشید که یک اوربیتال غیر پیوندی، یک جفت الکترون منفرد بر روی اکسیژن، نیتروژن یا هالوژن است. گروههای موجود در یک مولکول که نور را جذب میکنند به عنوان کروموفور شناخته میشوند. علاوه بر مولکولهای آلی، اتمهای غیر آلی منفرد و نیز ترکیبات یونی فلزی نیز میتوانند جذب شوند. ترکیبات غیر آلی قله طیفی واضحی با پهنای کم دارند. یک نمونه از ترکیبات غیر آلی کمیاب، اکسید هولمیوم است که طیف آن در شکل نشان داده شده است.
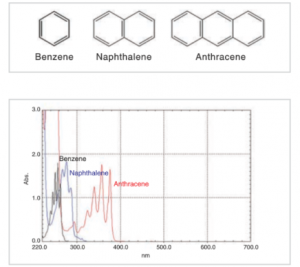
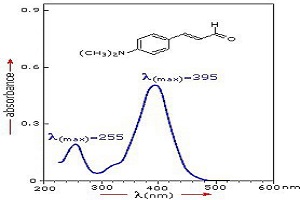
ترکیبات آلی بسیاری وجود دارند که دارای سیستم پیوند دوگانه مزدوج هستند. این سیستمها روی قلههای طیف و شدت آنها تأثیر دارند.
شکل بالا ساختار بنزن، نفتالین و آنتراسن و طیف جذبی حاصل از حل شدن این ترکیبات در اتانول و تجزیه و تحلیل محلولهای حاصل را نشان میدهد. غلظتها به گونهای تنظیم شده شدت جذب اجزا تقریباً یکسان باشد. در شکل مشاهده میشود که با بزرگتر شدن سیستم مزدوج، طیف به سمت طول موجهای بلندتر کشیده میشود. علت چیست؟ برای درک این موضوع، رابطه بین انرژی نور و حرکت الکترونها را در نظر بگیرید.
نور خاصیت دوگانه موجی-ذره ای دارد. انرژی یک فوتون به صورت hc/λ بیان میشود. h ثابت پلانک، c سرعت نور و λ طول موج است. جذب در نواحی فرابنفش و مرئی به جابهجایی الکترونها وابسته است. حالت حرکت الکترونهای π در سیستم مزدوج راحتتر از الکترونهای σ -که چارچوبهای مولکولی را شکل میدهند- تغییر میکند. اگر یک فوتون با یک الکترون π برخورد کند، حرکت آن الکترون به راحتی تغییر میکند (حتی اگر فوتون انرژی خیلی کمی داشته باشد). الکترونهای π در سیستمهای نسبتاً بزرگ به راحتی تحت تأثیر فوتونهای کم انرژی قرار میگیرند. انتقال، نحوه جذب انرژی فوتونها توسط الکترون را بیان میکند. اگر یک فوتون انرژی نسبتاً کمی داشته باشد، مقدار hc/λ برای آن فوتون نسبتاً کم است؛ بنابراین مقدار λ نسبتاً زیاد است. λ به عنوان طول موج جذب مشاهده میشود. پس اگر یک سیستم مزدوج وجود داشته باشد، قلهها در طول موجهای بلندتر ظاهر میشوند.
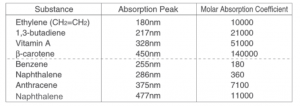
جدول بالا طول موج قلهها و ضرایب جذب مولار ترکیبات مختلف آلی را نشان میدهد. ضریب جذب مولار، اندازهگیری میزان جذب نور توسط یک ماده است. هرچه مقدار آن بیشتر باشد، میزان جذب بیشتر میشود. در سیستمهای مزدوج بزرگتر، قلهها به سمت طول موجهای بلندتر کشیده میشوند.
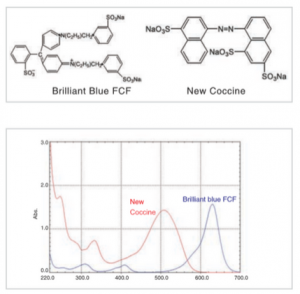
شکل بالایی ساختار رنگهای غذایی و شکل پایین طیف جذب آنها را نشان میدهد. همانطور که در شکل نشان داده شده، رنگهای غذایی تمایل به داشتن سیستمهای بزرگ مزدوج دارند؛ بنابراین طول موج قله آنها به سمت طول موجهای بزرگتر کشیده میشود و قلهها در منطقه مرئی (۴۰۰ تا ۷۰۰ نانومتر) ظاهر میشوند. به همین دلیل است که آنها را رنگی میبینیم. جالب است بدانید که رنگی که میبینیم رنگی است که توسط ماده جذب نمیشود (رنگ مکمل نامیده میشود).
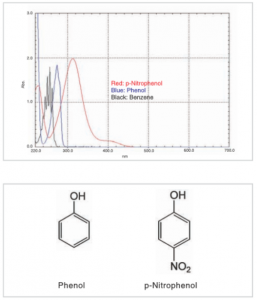
قلههای جذب تحت تأثیر گروه عاملی هستند. شکل بالا طیف جذب بنزن و فنول (از یک گروه هیدروکسیل و یک گروه نیترو متصل به حلقه بنزن تشکیل شده است) را نشان میدهد. گروههای عملکردی بر سیستم مزدوج تأثیر میگذارند و باعث میشوند که قلههای جذب در طول موجهای بلندتر از طول موج قله ظاهر شوند (از ۴۰۰ نانومتر فراتر نمیروند). بنابراین رنگ ترکیبات آلی به شدت تحت تأثیر اندازه سیستم مزدوج است
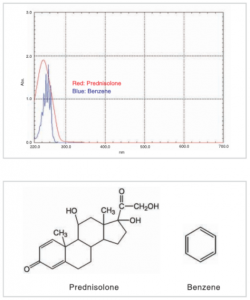
شکلهای بالا طیف جذب پردنیزولون را که به عنوان ماده دارویی استفاده میشود، نشان میدهد. علیرغم اینکه این ماده یک چارچوب مولکولی بزرگ دارد، سیستم مزدوج آن کوچک است. بنابراین قلههای آن تقریباً در همان موقعیت قلههای بنزن است.
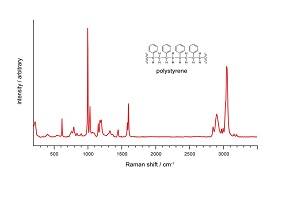
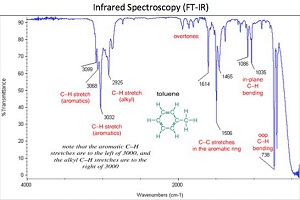
همانطور که در شکل بالا دیده میشود، ناحیه فروسرخ طول موج بلندتری نسبت به نور مرئی/فرابنفش دارد. انرژی در این ناحیه پایین است و کمتر میتواند الکترونها را تحت تأثیر قرار دهد. اما روی پیوندها (سطح انرژی ارتعاشی و چرخشی) اثر میگذارد. به این دلیل طیف سنجی مادون قرمز اطلاعات مربوط به پیوندهای مولکولی را به دست میدهد که برای شناسایی و توصیف مواد به کار میرود
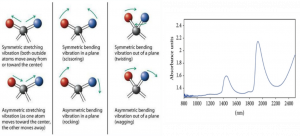
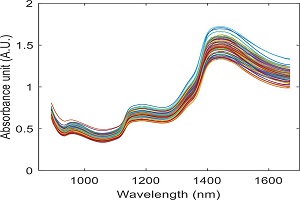
اطلاعاتی که ناحیه فروسرخ نزدیک به ما میدهد، شبیه به اطلاعاتی است که ناحیه فروسرخ میدهد. پس چرا با اینکه چیز بیشتری ارائه نمیدهد از آن استفاده میکنیم؟ با توجه به قانون بیرلامبرت، طول مسیر (ماده) برای طیف سنجی NIR میتواند طولانیتر باشد. طول مسیرهایی که در MIR استفاده میشود میکرون است؛ در حالی که در NIR میتوانیم با میلیمتر نیز کار کنیم. استفاده از طول مسیر بیشتر برای کار کردن با برخی مواد میتواند بسیار مفید باشد
بعد Z به عنوان فاصله از قسمت تحتانی سلول در دستگاه تا مرکز نوری است. این عدد برای لنا برابر ۱۵ میلیمتر است.
هر شرکت برای اطمینان از عملکرد مطلوب دستگاه، ارتفاع، طول و عرض قرارگیری پرتو نور را بهینه میکند. این اعداد زمانی اهمیت پیدا میکنند که حجم نمونه کم باشد و این حجم کم باید در راستای مسیر نور قرار گیرد.